Le polyéthylène téréphtalate (PET) est un des polymères synthétiques les plus couramment utilisés après le polyéthylène et le polypropylène, dans les emballages et les produits textiles. La dégradation naturelle du PET pouvant prendre plusieurs siècles, son accumulation devient donc un enjeu environnemental majeur qui risque de perdurer, à moins que des solutions innovantes ne soient identifiées. Samuel Tranier et Jean-Denis Pedelacq de l'Institut de Pharmacologie et de Biologie Structurale à Toulouse commentent un article paru récemment dans PNAS décrivant la caractérisation par rayons-X d'une enzyme mangeuse de PET.
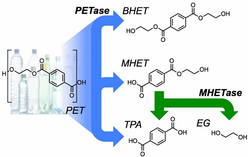
Figure 1 - La PETase catalyse la dépolymérisation du PET en BHET, MHET et TPA. La MHETase convertit le MHET en TPA et EG. Fig. 1 in Austin et al. (2018).
Récemment, une équipe japonaise (Yoshida et al., 2016) a découvert une bactérie, baptisée Ideonella sakaiensis 201-F6, qui peut croitre en utilisant le PET comme source de carbone. Cette bactérie possède une enzyme (PETase) capable de convertir le PET en acide mono(2-hydroxyéthyl) téréphtalique (MHET) avec des traces d'acide téréphtalique (TPA) et de bis(2-hydroxyéthyl) téréphtalate (BHET). Le MHET peut ensuite être déconstruit en TPA et éthylène Glycol (EG) par une MHETase. Les enzymes PETase et MHETase sont sécrétées par I. sakaiensis et agissent de manière synergique pour dépolymériser le PET (Figure 1).
Afin de mieux comprendre la spécificité de substrat de la PETase de Ideonella sakaiensis envers le PET, sa structure cristallographique a été déterminée à 0.92 Å de résolution (Austin et al., 2018). Cette PETase présente un repliement de type α/β-hydrolase caractéristique des cutinases et des lipases avec toutefois un site catalytique plus ouvert que dans ses homologues (Figure 2). Des variants de la PETase ont été construits à partir d'alignement structuraux avec des cutinases d'origine bactérienne, dont un double mutant permettant de rétrécir le sillon catalytique. De façon surprenante, ce double mutant inspiré de l'architecture des cutinases et supposé perturber l'interaction avec le substrat, montre une efficacité accrue dans la dégradation du PET. De plus, les auteurs ont montré que cette PETase est capable de dégrader le PET mais également un autre type de polyester semi-aromatique : le polyethylene-2,5-furandicarboxylate (PEF). Par contre elle ne dégrade pas des polyesters aliphatiques.
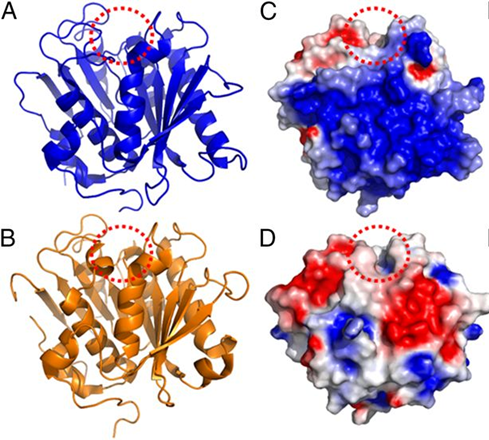
Figure 2 - Structure de la PETase de Ideonella sakaiensis. (A) Représentation schématique de la structure tridimensionnelle de la PETase à une résolution de 0,92 Å (code PDB : 6EQE). Le sillon catalytique est orienté vers le haut (cercle rouge en pointillés). B) Structure de la cutinase de T. fusca (code PDB : 4CG1) dans la même orientation. Représentation du potentiel électrostatique de surface (C) de la PETase et (D) de la cutinase de T. fusca en rouge (négatif) et en bleu (positif). Adaptée de Fig. 2 dans Austin et al. (2018).
Il reste malgré tout à optimiser cette enzyme avant de pouvoir envisager une application industrielle. Toutefois, cette étude pourra servir de base à l'optimisation de PETases afin d'améliorer leur capacité à dépolymériser le PET mais également d'autres polymères synthétique apportant ainsi une solution efficace à l'accumulation de plastique dans la nature.
Références :
Austin, H.P., Allen, M.D., Donohoe, B.S., Rorrer, N.A., Kearns, F.L., Silveira, R.L., Pollard, B.C., Dominick, G., Duman, R., El Omari, K., et al. (2018). Characterization and engineering of a plastic-degrading aromatic polyesterase. Proc. Natl. Acad. Sci. 115, E4350-E4357.
Yoshida, S., Hiraga, K., Takanaha, T., Taniguchi, I., Yamaji, H., Maeda, Y., Toyohara, K., Miyamoto, K., Kimura, Y., and Oda, K. (2016). A bacterium that degrades and assimilates poly(ethyleneterephthalate). Science 351, 1196–1199.
Texte: Samuel Tranier et Jean-Denis Pedelacq (Institut de Pharmacologie et de Biologie Structurale, Toulouse – juillet 2018)