
L'AFC félicite ses 3 lauréats du prix de thèse 2016. Les lauréats ont présenté leurs travaux lors du colloque de l'Association Française de Cristallographie du 4 au 7 juillet 2016 à Marseille.
Le prix AFC - Mention Biologie a été attribué à Guillaume Gaullier, Institut de Biologie Intégrative de la Cellule (I2BC) à Gif-sur-Yvette, thèse soutenue le 22 septembre 2015 sous la direction de Marie-Hélène Le Du. Titre: Étude structurale de l’assemblage du complexe télomérique humain TRF2/RAP1.
Le prix AFC - Mention Chimie a été attribué à Morgane Poupon, Laboratoire de Cristallographie et Sciences des Matériaux à Caen, thèse soutenue le 9 novembre 2015 sous la direction de Nicolas Barrier et Olivier Pérez. Titre - Synthèse d’oxydes à base d’éléments à paire libre (SeIV et TeIV) dans le but d’obtenir des structures cristallines non-centrosymétriques originales.
Le prix AFC - Mention Physique a été attribué à Maxime Dupraz, Laboratoire de Science et Ingénierie des Matériaux et Procédés (SIMAP) à Grenoble, thèse soutenue le 17 novembre 2015 sous la direction de Marc Verdier et Guillaume Beutier. Titre - Diffraction des rayons X cohérents appliquée à la physique du métal.
Le prix Biologie (Guillaume Gaullier):
 Effectuée au CEA de Saclay sous la direction de Marie-Hélène Le Du, ma thèse a porté sur l'étude structurale du complexe entre TRF2 (telomere repeat-binding factor 2) et RAP1 (repressor/activator protein 1), deux protéines télomériques humaines. Les télomères sont les extrémités des chromosomes des eucaryotes, ils sont constitués de répétitions d'un motif court riche en guanine et lié par des protéines spécifiques. L'intégrité des télomères est critique pour garantir la stabilité du génome. TRF2 et RAP1 sont les protéines télomériques les plus abondantes chez les mammifères (Takai et al, 2010), et sont essentielles pour établir un télomère fonctionnel : le retrait de TRF2 des télomères entraine en effet l'activation des voies de signalisation des dommages de l'ADN (Takai et al, 2003), et une fréquence élevée de fusions de chromosomes (voir par exemple Sarthy et al, 2009). Quand ma thèse a débuté, nous savions déjà que RAP1 s'associe à TRF2, par son domaine C-terminal et avec une affinité nanomolaire (Chen et al, 2011). Nous disposions aussi de structures tridimensionnelles de domaines isolés (Chen et al, 2011; Court et al, 2005; Fairall et al, 2001; Hanaoka et al, 2001), mais aucune étude structurale n'avait été réalisée sur les protéines entières ou leur complexe. Ce type d'étude représente un défi car aucune méthode expérimentale ne permet à elle seule de répondre à toutes les questions que soulèvent
Effectuée au CEA de Saclay sous la direction de Marie-Hélène Le Du, ma thèse a porté sur l'étude structurale du complexe entre TRF2 (telomere repeat-binding factor 2) et RAP1 (repressor/activator protein 1), deux protéines télomériques humaines. Les télomères sont les extrémités des chromosomes des eucaryotes, ils sont constitués de répétitions d'un motif court riche en guanine et lié par des protéines spécifiques. L'intégrité des télomères est critique pour garantir la stabilité du génome. TRF2 et RAP1 sont les protéines télomériques les plus abondantes chez les mammifères (Takai et al, 2010), et sont essentielles pour établir un télomère fonctionnel : le retrait de TRF2 des télomères entraine en effet l'activation des voies de signalisation des dommages de l'ADN (Takai et al, 2003), et une fréquence élevée de fusions de chromosomes (voir par exemple Sarthy et al, 2009). Quand ma thèse a débuté, nous savions déjà que RAP1 s'associe à TRF2, par son domaine C-terminal et avec une affinité nanomolaire (Chen et al, 2011). Nous disposions aussi de structures tridimensionnelles de domaines isolés (Chen et al, 2011; Court et al, 2005; Fairall et al, 2001; Hanaoka et al, 2001), mais aucune étude structurale n'avait été réalisée sur les protéines entières ou leur complexe. Ce type d'étude représente un défi car aucune méthode expérimentale ne permet à elle seule de répondre à toutes les questions que soulèvent 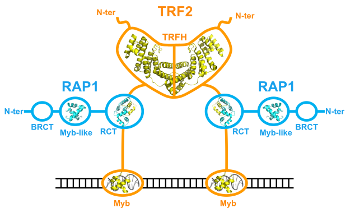 ce type de protéines multi-domaines. Mes travaux ont consisté à obtenir et intégrer des données issues de plusieurs méthodes expérimentales complémentaires : la cristallographie, mais aussi la diffusion des rayons X aux petits angles (SAXS), la microcalorimétrie, et des expériences d'empreinte protéique par acétylation des lysines. Les données de SAXS nous ont permis de confirmer que TRF2 est dimérique, RAP1 est monomérique, et le complexe TRF2/RAP1 contient deux monomères de RAP1 associés à un dimère de TRF2. Nos données suggèrent également un changement de conformation des protéines lors de l'assemblage du complexe. Une étude par microcalorimétrie comparant les propriétés d'interaction avec TRF2 de RAP1 entière et du domaine C-terminal isolé de RAP1 a permis de distinguer un signal détectable uniquement en présence de RAP1 entière, signifiant que la seule liaison du domaine C-terminal de RAP1 à TRF2 ne rend pas complètement compte de leur mode d'interaction.
ce type de protéines multi-domaines. Mes travaux ont consisté à obtenir et intégrer des données issues de plusieurs méthodes expérimentales complémentaires : la cristallographie, mais aussi la diffusion des rayons X aux petits angles (SAXS), la microcalorimétrie, et des expériences d'empreinte protéique par acétylation des lysines. Les données de SAXS nous ont permis de confirmer que TRF2 est dimérique, RAP1 est monomérique, et le complexe TRF2/RAP1 contient deux monomères de RAP1 associés à un dimère de TRF2. Nos données suggèrent également un changement de conformation des protéines lors de l'assemblage du complexe. Une étude par microcalorimétrie comparant les propriétés d'interaction avec TRF2 de RAP1 entière et du domaine C-terminal isolé de RAP1 a permis de distinguer un signal détectable uniquement en présence de RAP1 entière, signifiant que la seule liaison du domaine C-terminal de RAP1 à TRF2 ne rend pas complètement compte de leur mode d'interaction.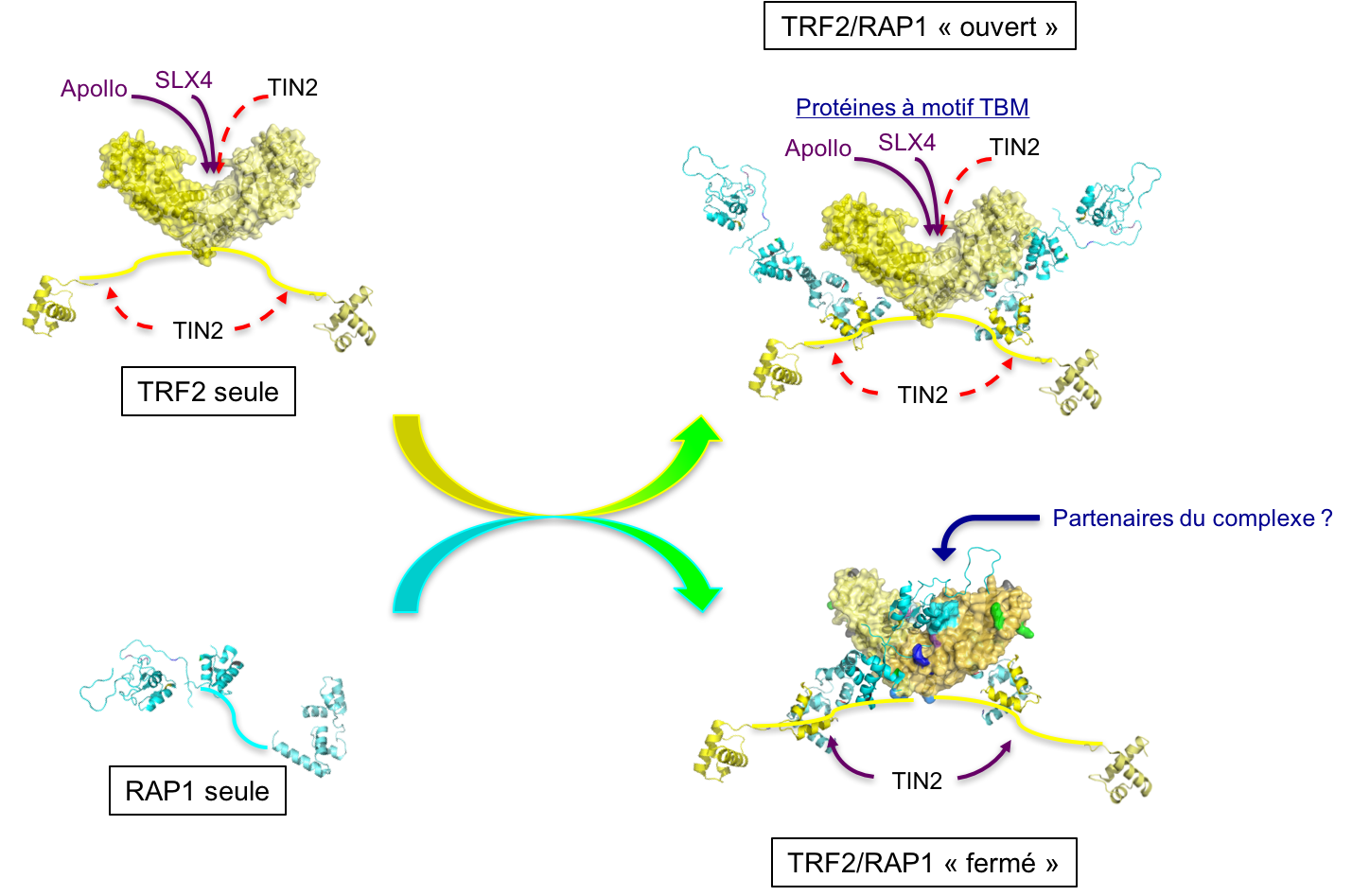 La région N-terminale de RAP1 contient un motif Y-x-L-x-P décrit dans la littérature comme un motif d'interaction avec le domaine TRFH (domaine de dimérisation) de TRF2 (Chen et al, 2008; Kim et al, 2009) et appelé TBM (TRFH-binding motif). La structure cristallographique du domaine TRFH de TRF2 en complexe avec un peptite de RAP1 contenant le motif Y-x-L-x-P montre qu'il s'agit bien d'un TBM, et la mutation en alanine de ces trois résidus dans RAP1 entière abolit le signal biphasique observé par microcalorimétrie, ce qui confirme l'implication de ce motif dans l'interaction entre les protéines entières. Finalement, les expériences d'empreinte protéique ont montré que l'interaction entre TRF2 et RAP1 engage de vastes surfaces des deux protéines, et que ces surfaces sont plus réduites dans le complexe contenant RAP1 mutée dans le TBM. L'ensemble de nos données est en faveur d'un modèle selon lequel RAP1 lie TRF2 avec une haute affinité par son domaine C-terminal, et peut selon les conditions occuper le site de liaison des motifs TBM dans le domaine TRFH de TRF2 (figure à droite). Ces résultats ont été publiés peu après la fin de ma thèse (Gaullier et al, 2016). Nous avons formulé deux hypothèses (non mutuellement exclusives) sur la fonction de ce mode d'interaction : la première propose qu'un des rôles de RAP1 pourrait être de réguler l'accès au site de liaison des motifs TBM par d'autres protéines contenant ces motifs, la seconde propose que la dimérisation de la région N-terminale de RAP1 induite par son mode d'interaction avec TRF2 donnerait au complexe de nouvelles spécificités d'interaction avec d'autres partenaires protéiques. Un article publié récemment (Rai et al, 2016) présente des résultats en faveur de la première hypothèse, qui montrent que la région N-terminale de RAP1 est nécessaire pour réprimer la localisation télomérique de SLX4, une protéine interagissant avec TRF2 par un motif TBM (Wan et al, 2013). La seconde hypothèse reste encore à tester.
La région N-terminale de RAP1 contient un motif Y-x-L-x-P décrit dans la littérature comme un motif d'interaction avec le domaine TRFH (domaine de dimérisation) de TRF2 (Chen et al, 2008; Kim et al, 2009) et appelé TBM (TRFH-binding motif). La structure cristallographique du domaine TRFH de TRF2 en complexe avec un peptite de RAP1 contenant le motif Y-x-L-x-P montre qu'il s'agit bien d'un TBM, et la mutation en alanine de ces trois résidus dans RAP1 entière abolit le signal biphasique observé par microcalorimétrie, ce qui confirme l'implication de ce motif dans l'interaction entre les protéines entières. Finalement, les expériences d'empreinte protéique ont montré que l'interaction entre TRF2 et RAP1 engage de vastes surfaces des deux protéines, et que ces surfaces sont plus réduites dans le complexe contenant RAP1 mutée dans le TBM. L'ensemble de nos données est en faveur d'un modèle selon lequel RAP1 lie TRF2 avec une haute affinité par son domaine C-terminal, et peut selon les conditions occuper le site de liaison des motifs TBM dans le domaine TRFH de TRF2 (figure à droite). Ces résultats ont été publiés peu après la fin de ma thèse (Gaullier et al, 2016). Nous avons formulé deux hypothèses (non mutuellement exclusives) sur la fonction de ce mode d'interaction : la première propose qu'un des rôles de RAP1 pourrait être de réguler l'accès au site de liaison des motifs TBM par d'autres protéines contenant ces motifs, la seconde propose que la dimérisation de la région N-terminale de RAP1 induite par son mode d'interaction avec TRF2 donnerait au complexe de nouvelles spécificités d'interaction avec d'autres partenaires protéiques. Un article publié récemment (Rai et al, 2016) présente des résultats en faveur de la première hypothèse, qui montrent que la région N-terminale de RAP1 est nécessaire pour réprimer la localisation télomérique de SLX4, une protéine interagissant avec TRF2 par un motif TBM (Wan et al, 2013). La seconde hypothèse reste encore à tester.Références:
Chen Y, Yang Y, van Overbeek M, Donigian JR, Baciu P, de Lange T & Lei M (2008) A shared docking motif in TRF1 and TRF2 used for differential recruitment of telomeric proteins. Science 319: 1092–1096
Chen Y, Rai R, Zhou Z-R, Kanoh J, Ribeyre C, Yang Y, Zheng H, Damay P, Wang F, Tsujii H, Hiraoka Y, Shore D, Hu H-Y, Chang S & Lei M (2011) A conserved motif within RAP1 has diversified roles in telomere protection and regulation in different organisms. Nat. Struct. Mol. Biol 18: 213–221
Court R, Chapman L, Fairall L & Rhodes D (2005) How the human telomeric proteins TRF1 and TRF2 recognize telomeric DNA: a view from high-resolution crystal structures. EMBO Rep. 6: 39–45
Fairall L, Chapman L, Moss H, de Lange T & Rhodes D (2001) Structure of the TRFH dimerization domain of the human telomeric proteins TRF1 and TRF2. Mol. Cell 8: 351–361
Gaullier G, Miron S, Pisano S, Buisson R, Le Bihan Y-V, Tellier-Lebègue C, Messaoud W, Roblin P, Guimarães BG, Thai R, Giraud-Panis M-J, Gilson E & Le Du M-H (2016) A higher-order entity formed by the flexible assembly of RAP1 with TRF2. Nucl. Acids Res. 44: 1962–1976
Hanaoka S, Nagadoi A, Yoshimura S, Aimoto S, Li B, de Lange T & Nishimura Y (2001) NMR structure of the hRap1 Myb motif reveals a canonical three-helix bundle lacking the positive surface charge typical of Myb DNA-binding domains. J. Mol. Biol. 312: 167–175
Kim H, Lee O-H, Xin H, Chen L-Y, Qin J, Chae HK, Lin S-Y, Safari A, Liu D & Songyang Z (2009) TRF2 functions as a protein hub and regulates telomere maintenance by recognizing specific peptide motifs. Nat. Struct. Mol. Biol. 16: 372–379
Rai R, Chen Y, Lei M & Chang S (2016) TRF2-RAP1 is required to protect telomeres from engaging in homologous recombination-mediated deletions and fusions. Nat Commun 7: 10881
Takai KK, Hooper S, Blackwood S, Gandhi R & de Lange T (2010) In vivo stoichiometry of shelterin components. J. Biol. Chem. 285: 1457–1467 doi:10.1074/jbc.M109.038026
Takai H, Smogorzewska A & de Lange T (2003) DNA Damage Foci at Dysfunctional Telomeres. Current Biology 13: 1549–1556
Sarthy J, Bae NS, Scrafford J & Baumann P (2009) Human RAP1 inhibits non-homologous end joining at telomeres. EMBO J. 28: 3390–3399
Wan B, Yin J, Horvath K, Sarkar J, Chen Y, Wu J, Wan K, Lu J, Gu P, Yu EY, Lue NF, Chang S, Liu Y & Lei M (2013) SLX4 Assembles a Telomere Maintenance Toolkit by Bridging Multiple Endonucleases with Telomeres. Cell Reports 4: 861–869
Le prix Chimie (Morgane Poupon):

Pour obtenir ces nouveaux oxydes de tellure et de sélénium NCs nous avons fait le choix d'utiliser les synthèses par voie hydrothermale basse pression et basse température. Un premier travail de recherche a été réalisé afin de comprendre les mécanismes et les différents paramètres influençant les synthèses hydrothermales (concentration, cycle de température, évolution du nombre d'équivalents de soude, changement de précurseur, etc.). À l'issue de ce travail nous avons pu mettre en place un protocole expérimental, permettant l'étude généralisée de système ternaire M-Te/Se-O (M = Ca, Sr, Ba, Ni, Co) par synthèse hydrothermale. À partir de ces synthèses nous avons suivie deux axes de recherche :
- l'étude structurale de nouveaux polymorphes CaTeO3 obtenus par déshydratations des polymorphes α et β-CaTeO3(H2O) (Figure 1) et par synthèse hydrothermale directe,
- l'étude des structures, des propriétés magnétiques et diélectriques, des composés isotypes Co3Te2O6(OH)2(H2O)0.5 et Ni3Se2O6(OH)2 et des composés hydratés CoSeO3(H2O)x (x = 3/4 et 1/3) et α- et β-NiSeO3(H2O).
La première étude, sur le système Ca-Te-O, nous a permis de mettre en évidence deux nouveaux polymorphes α et β-CaTeO3(H2O), ainsi que quatre nouveaux polymorphes CaTeO3. Les caractérisations des structures ont pu être effectuées à partir de la diffraction des rayons X sur poudre et sur monocristal. Nous avons pu notamment décrire la structure lamellaire désordonnée de la phase β-CaTeO3(H2O) par une structure modulée à l'aide du formalise des superespaces. Parmi ces nouveaux polymorphes trois sont non-centrosymétriques
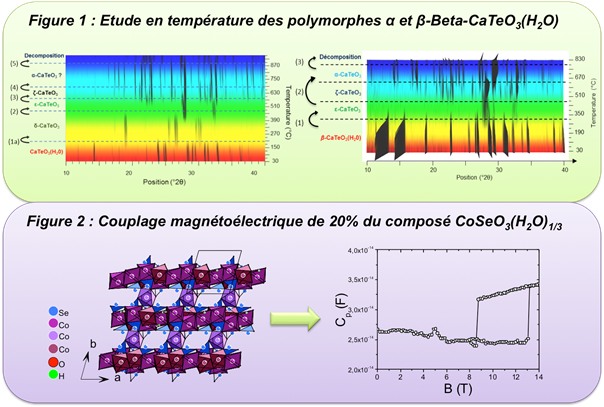 (α-CaTeO3(H2O), δ-CaTeO3 et η- CaTeO3) et l'analyse de leurs propriétés d'optique non linéaire par des mesures de génération de second harmonique, a pu être effectuée. Lors de la deuxième étude, nous avons pu notamment résoudre la structure NC maclée de la nouvelle phase CoSeO3(H2O)3/4 et mettre en évidence la présence d'un couplage magnétoélectrique de l'ordre de 4,5% en dessous de 7K. Néanmoins, c'est pour la phase CoSeO3(H2O)1/3 que nous avons pu mettre en évidence le plus fort couplage magnétoélectrique, qui est de l'ordre de 20% en dessous de 12K. (Figure 2)
(α-CaTeO3(H2O), δ-CaTeO3 et η- CaTeO3) et l'analyse de leurs propriétés d'optique non linéaire par des mesures de génération de second harmonique, a pu être effectuée. Lors de la deuxième étude, nous avons pu notamment résoudre la structure NC maclée de la nouvelle phase CoSeO3(H2O)3/4 et mettre en évidence la présence d'un couplage magnétoélectrique de l'ordre de 4,5% en dessous de 7K. Néanmoins, c'est pour la phase CoSeO3(H2O)1/3 que nous avons pu mettre en évidence le plus fort couplage magnétoélectrique, qui est de l'ordre de 20% en dessous de 12K. (Figure 2)Ce travail de thèse a montré la pertinence de la synthèse hydrothermale pour obtenir de nouvelles phases non-centrosymétriques, dans le cas de l'étude d'oxydes ternaires à base d'éléments à paire d'électrons libres, tels que le tellure et le sélénium (IV). Nous avons également montré que ces phases, lorsqu'elles contenaient des cations magnétiques, étaient de sérieux candidats dans la recherche de matériaux multiferroïques ou présentant un fort couplage magnétoélectrique.
Références:
[1] T. Hahn, International Tables for Crystallography, D. Reidel Publishing Compagny: Dordecht, 1983.
[2] Velev, J. P.; Jaswal, S. S.; Tsymbal, E. Y. Philos. Trans. R. Soc. Lond. Math. Phys. Eng. Sci. 2011, 369 (1948), 3069–3097.
[3] Eerenstein, W.; Mathur, N. D.; Scott, J. F. Nature 2006, 442 (7104), 759–765.
[4] Schmid, H. J. Phys. Condens. Matter 2008, 20 (43), 434201.
[5] Halasyamani, P. S. Chem. Mater. 2004, 16 (19), 3586–3592.
[6] Poupon, Morgane; Barrier, Nicolas; Petit, Sebastien; et al. Inorg. Chem., 2015, 54(12), 5660-5670
Le prix Physique (Maxime Dupraz): Les propriétés physiques à petite échelle de longueur diffèrent fortement de celles du matériau massif, typiquement en deçà du micromètre [1]. Par exemple, la résistance mécanique augmente quand la taille diminue et de fortes contraintes résiduelles liés aux procédés d'élaboration sont présentes au sein de nanostructures [2]. Il existe ainsi un besoin d'une meilleure compréhension de la relation entre la microstructure et les propriétés des matériaux aux échelles sub-micrométriques. La diffraction des rayons-X cohérents (CXD) est une technique émergente de synchrotron qui est très sensible aux champs de déformation et à la présence de défauts structuraux [3]. En principe, une image 3D de la microstructure de l'échantillon peut-être obtenue à partir des données de diffraction cohérente [4]. De plus, les rayons X cohérents peuvent être aussi utilisés pour l'imagerie par holographie de domaines/structures magnétiques [5]. Ces deux techniques sont mises en pratique dans ces travaux de thèse.
Les propriétés physiques à petite échelle de longueur diffèrent fortement de celles du matériau massif, typiquement en deçà du micromètre [1]. Par exemple, la résistance mécanique augmente quand la taille diminue et de fortes contraintes résiduelles liés aux procédés d'élaboration sont présentes au sein de nanostructures [2]. Il existe ainsi un besoin d'une meilleure compréhension de la relation entre la microstructure et les propriétés des matériaux aux échelles sub-micrométriques. La diffraction des rayons-X cohérents (CXD) est une technique émergente de synchrotron qui est très sensible aux champs de déformation et à la présence de défauts structuraux [3]. En principe, une image 3D de la microstructure de l'échantillon peut-être obtenue à partir des données de diffraction cohérente [4]. De plus, les rayons X cohérents peuvent être aussi utilisés pour l'imagerie par holographie de domaines/structures magnétiques [5]. Ces deux techniques sont mises en pratique dans ces travaux de thèse. Tout d'abord, nous démontrons que la CXD permet d'identifier quantitativement dans l'espace réciproque tous les types de dislocations, dans le cas d'arrangements simples [6]. Pour des structures plus complexes de défauts, la reconstruction numérique de la densité électronique et de la phase permet de déterminer leur nature et microstructure 3D. Ces deux méthodologies, i.e. l'analyse de la signature des défauts dans l'espace réciproque et la reconstruction dans l'espace réel, sont appliquées au cours d'une expérience de déformation in situ d'une micro-cristallite d'or par nano-indentation. En s'appuyant sur les reconstructions 3D à différents stades de la sollicitation mécanique, la germination une boucle de dislocation prismatique est clairement identifiée. L'interaction entre les défauts germés et la déformation résiduelle dans la cristallite, conduit à une relaxation équivalente à un “recuit mécanique”. De plus la sensibilité de la technique est évaluée dans le cas d'interfaces (surface libre, mâcle, hétéro-épitaxie).
Tout d'abord, nous démontrons que la CXD permet d'identifier quantitativement dans l'espace réciproque tous les types de dislocations, dans le cas d'arrangements simples [6]. Pour des structures plus complexes de défauts, la reconstruction numérique de la densité électronique et de la phase permet de déterminer leur nature et microstructure 3D. Ces deux méthodologies, i.e. l'analyse de la signature des défauts dans l'espace réciproque et la reconstruction dans l'espace réel, sont appliquées au cours d'une expérience de déformation in situ d'une micro-cristallite d'or par nano-indentation. En s'appuyant sur les reconstructions 3D à différents stades de la sollicitation mécanique, la germination une boucle de dislocation prismatique est clairement identifiée. L'interaction entre les défauts germés et la déformation résiduelle dans la cristallite, conduit à une relaxation équivalente à un “recuit mécanique”. De plus la sensibilité de la technique est évaluée dans le cas d'interfaces (surface libre, mâcle, hétéro-épitaxie).
L'holographie magnétique est utilisée pour déterminer les structures magnétiques dans des plots micrométriques de permalloy (FeNi) qui prennent la forme de vortex. De plus leur dynamique sous champ magnétique est résolue en temps (à la nanoseconde).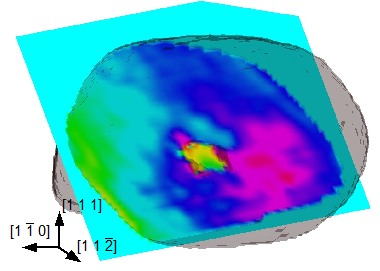
Références:
[1] Uchic et al. (2004), Science 305, 986
[2] Bei et al. (2008), Acta. Mater. 56, 4762-4770.
[3] Robinson & Harder (2009). Nature Materials 8, 291
[4] Newton et al. (2010). Nature Materials 9, 120-124
[5] Eisebitt et ak. (2004) Nature 432, 885
[6] Dupraz et al. (2015). J. Appl. Cryst. 48, 621





