« La révolution n'est pas cristallisée: une nouvelle méthode balaie la biologie structurale ». C'est ainsi que Nature commente fin 2015 les développements récents en Cryo-MET. Patrick Bron et Stefano Trapani ( Centre de Biochimie Structurale, Montpellier ) commentent ces développements en prenant comme exemple l'étude récente publiée dans Nature par une équipe Strasbourgeoise de l'Institut de Génétique et de Biologie Moléculaire et Cellulaire.
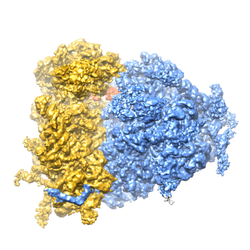
En 2015 la structure du ribosome humain (un gros édifice macromoléculaire de 4.5 MDa de masse qui intervient dans la biosynthèse des protéines dans les cellules, illustré dans la figure) a été publiée à une résolution quasi-atomique par une équipe Strasbourgeoise de l’Institut de Génétique et de Biologie Moléculaire et Cellulaire (IGBMC, Illkirch) (1). Cette étude structurale fournit des détails sans précédents sur des régions fonctionnellement clés du ribosome telles que le site catalytique de transfert des groupes peptidiques, la région de décodage de l'ARN et des poches potentiellement exploitables par des antibiotiques et médicaments. Compte tenu du fait que le ribosome est une cible liée à plusieurs maladies humaines (cancer et maladies infectieuses), l'élucidation de sa structure à une résolution atomique ou quasi-atomique revête une importance médicale particulière. Cette étude structurale ne repose cependant pas sur la radio-cristallographie, la technique d'excellence des biologistes structuraux depuis plus qu'un demi-siècle (rappelons la découverte de la double hélice de l'ADN en 1953 et des premières structures protéiques repliées ―hémoglobine et myoglobine― en 1959). Les chercheurs Alsaciens ont pu construire et affiner (sous contraintes stéréo-chimiques) un modèle moléculaire de ~220 000 atomes (non-hydrogène) en utilisant des cartes de densité électronique issues de la cryo-microscopie électronique en transmission (cryo-MET) et ayant une résolution moyenne de 3.6 Å (pouvant atteindre localement 2.9 Å dans les régions de la structure les plus stables). Les résultats de cette étude s'ajoutent aux structures ribosomales de différents organismes élucidées pendant la dernière quinzaine d'années et qui sont en train de dévoiler de plus en plus en détail les mécanismes moléculaires de traduction de l'information génétique.
La cryo-MET est une technique de la microscopie électronique à transmission qui consiste à congeler très rapidement un échantillon biologique afin de le piéger dans une mince couche de glace amorphe, puis de l’observer à l’aide d’un microscope électronique adapté (figure ci-dessous, source, image par Wah Chiu). Pour cela, l’échantillon congelé est maintenu à une température très basse au sein du microscope électronique et des images de l’échantillon sont enregistrées sous des doses d’électrons extrêmement faibles ; ceci afin de limiter les dégâts dits d’irradiation. L’apparition de la cryo-MET date du milieu des années 80. Depuis lors, de très nombreux développements ont été réalisés tant au niveau des microscopes, afin d’acquérir des images de meilleurs qualités, que dans la préparation des échantillons biologiques et l’analyse et le traitement des images.
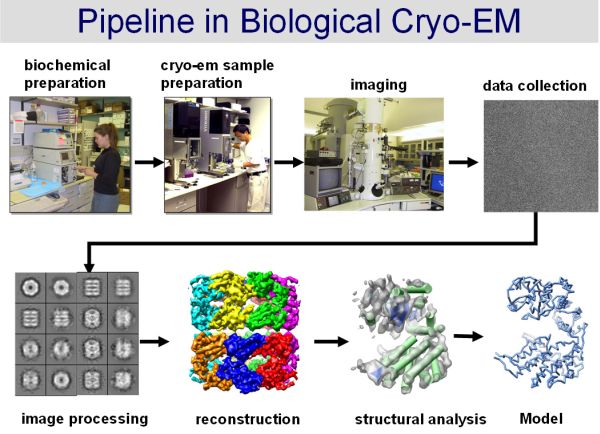
La cryo-MET sera donc très probablement une des techniques majeures utilisée par les biologistes structuraux dans les prochaines années.
1. Khatter H, Myasnikov AG, Natchiar SK, & Klaholz BP (2015): Structure of the human 80S ribosome. Nature 520(7549):640-645.
2. Bartesaghi A et al. (2015): 2.2 Å resolution cryo-EM structure of beta-galactosidase in complex with a cell-permeant inhibitor. Science 348(6239):1147-1151.
3. Tang G et al. (2007) EMAN2: an extensible image processing suite for electron microscopy. J. Struct. Biol. 157(1):38-46.
4. Scheres SH (2012) RELION: implementation of a Bayesian approach to cryo-EM structure determination. J. Struct. Biol. 180(3):519-530.
5. Brown A et al. (2015) Tools for macromolecular model building and refinement into electron cryo-microscopy reconstructions. Acta Cryst. D, 71(Pt 1):136-153.