L'European XFEL, inauguré le premier septembre 2017 à Hambourg, accueille actuellement ses premiers utilisateurs. Cette nouvelle source européenne de rayons X est un laser à électrons libres émettant des flashs de rayons X ultra-intenses et ultracourts (XFEL pour l'expression anglaise de X-ray Free Electron Laser) : une seule impulsion comporte de l'ordre de 1012 photons, ce qui correspond au nombre de photons émis par seconde sur une ligne de lumière d'une source de rayonnement synchrotron.
Cette intensité permet de réaliser des expériences basées sur des impulsions individuelles. La durée de ces impulsions peut être ajustée entre quelques centaines de femtosecondes et l'échelle de la femtoseconde, voire sous-femtoseconde. Ceci permet l'application des techniques de rayons X avancées, développées et affinées autour des sources du rayonnement synchrotron pendant les dernières décades, à l'étude de phénomènes ultrarapides – domaine d'excellence des lasers IR depuis longtemps. Le XFEL étant un laser, le rayonnement émis est caractérisé par un très haut degré de cohérence permettant l'exploitation des phénomènes d'interférence entre ces rayons X. Par ailleurs, avec un nombre de photons par volume de cohérence de l'ordre de 109, les XFELs sont en train de créer un nouveau domaine de recherche de la physique non-linéaire avec des rayons X. Avec ces propriétés sans précédents, les XFELs, dont il n'existe que quelques exemplaires dans le monde, sont en train de révolutionner une grande variété d'axes de recherche, notamment en physique, en chimie et en biologie.
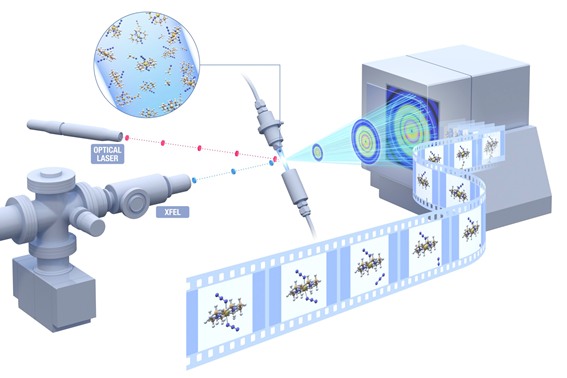

Illustration du principe de l'imagerie des nano-objets individuels par diffraction des rayons X cohérents. Des nano-objets sont injectés individuellement pour intercepter une impulsion de rayons X. Le diagramme de diffraction produit par cette impulsion de rayons X femtoseconde caractérise la structure du nano-objet avant que la structure a eu le temps à évoluer, provoquer par l'absorption des rayons X de l'impulsion de rayons X intense. Par répétition sur un grand nombre de nano-objets, des données de diffraction sont accumulées pour retrouver la structure trois dimensionnelles du nano-objet. Un laser IR synchronisé peut être utilisé pour excité une dynamique structurale dans le nano-objet dont l'évolution peut être caractérisé par la diffraction des rayons X après un délai spécifique. © European XFEL / Rey.Hori
Depuis l'arrivée en 2009 du LCLS à Stanford (USA), le premier XFEL émettant des rayons X durs la cristallographie est devenue une des activités phares. Elle exploite pleinement les propriétés uniques des XFELs qui permettent le développement de nouvelles approches de cristallographie pour l'analyse de la structure atomique de la matière. Au premier plan de ces nouvelles approches c'est la technique d'imagerie par diffraction des rayons X cohérents (CDI, pour coherent diffraction imaging) qui est en cours de développement. Cette technique se propose pour l'identification de la structure atomique des nanoparticules, ou bien de macromolécules biologiques comme les protéines. Ceci permettrait, à terme, de surmonter la nécessité de cristalliser ces molécules, ce qui est souvent le goulet d'étranglement de la cristallographie classique des macromolécules biologiques. La technique CDI est basée sur le concept de 'diffraction-avant-destruction' ce qui veut dire que l'impulsion X est tellement courte que la diffraction de rayons X a eu lieu avant que des modifications structurales n'aient eu le temps de se développer. Ces modifications proviennent des interactions répulsives entre des atomes ionisés qui à terme résultent dans l'explosion Coulombienne du nano-objet lui-même. Il faut noter qu'une telle mesure ne donne qu'une seule projection de la structure 3D. Elle doit être répétée jusqu'à ce que l'ensemble de données 3D soit accumulé.
Depuis l'arrivée en 2009 du LCLS à Stanford (USA), le premier XFEL émettant des rayons X durs la cristallographie est devenue une des activités phares. Elle exploite pleinement les propriétés uniques des XFELs qui permettent le développement de nouvelles approches de cristallographie pour l'analyse de la structure atomique de la matière. Au premier plan de ces nouvelles approches c'est la technique d'imagerie par diffraction des rayons X cohérents (CDI, pour coherent diffraction imaging) qui est en cours de développement. Cette technique se propose pour l'identification de la structure atomique des nanoparticules, ou bien de macromolécules biologiques comme les protéines. Ceci permettrait, à terme, de surmonter la nécessité de cristalliser ces molécules, ce qui est souvent le goulet d'étranglement de la cristallographie classique des macromolécules biologiques. La technique CDI est basée sur le concept de 'diffraction-avant-destruction' ce qui veut dire que l'impulsion X est tellement courte que la diffraction de rayons X a eu lieu avant que des modifications structurales n'aient eu le temps de se développer. Ces modifications proviennent des interactions répulsives entre des atomes ionisés qui à terme résultent dans l'explosion Coulombienne du nano-objet lui-même. Il faut noter qu'une telle mesure ne donne qu'une seule projection de la structure 3D. Elle doit être répétée jusqu'à ce que l'ensemble de données 3D soit accumulé.
La résolution spatiale obtenue par CDI est encore limitée, mais une autre technique nouvelle est en plein essor depuis 2011 : la cristallographie sérielle femtoseconde (SFX, serial femtosecond crystallography). Elle consiste à faire coïncider un flux de nanocristaux de protéines avec les impulsions de rayons X, collectant ainsi une myriade de clichés de diffraction. Étant donné l'extrême intensité du faisceau de rayons X, chaque cristal impacté explose immédiatement après que l'information de diffraction a été collectée – d'où la nécessité de constamment renouveler l'échantillon de façon « sérielle ». La brièveté des impulsions X permet de réaliser des véritables films ultra-rapides de protéines en action dans des expériences de type pompe-sonde, ou l'activité biologique est déclenchée dans la protéine cristalline dans un court délai, distinct mais variable, avant l'impact d'une impulsion de rayons X. Un tel exemple a été publié récemment par un consortium international dirigé par des chercheurs à l'Institut de Biologie Structurale à Grenoble (Coquelle et al. (2017)). Une picoseconde après l'activation par un flash laser lumineux d'une protéine fluorescente photocommutable, les chercheurs ont pu déterminer la structure de cette dernière dans son état excité et observer le chromophore – la partie de la protéine qui absorbe la lumière – dans un état tordu (« twisté »), à mi-chemin entre les conformations stables des états on et off (cf. figure ci-dessous).
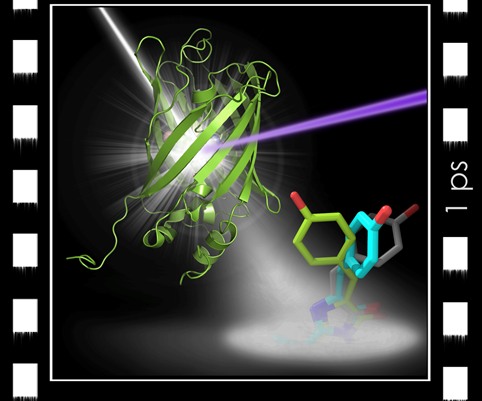 Cinéma ultra-rapide d'une protéine en action. La protéine fluorescente (verte) est excitée par un laser de lumière visible (rayon violet) et impactée par une impulsion de rayons X (rayon blanc) produite par un laser X à électrons libres. Une picoseconde après excitation, le chromophore (bleu) au cœur de la protéine est observé à mi-chemin entre les deux formes stables (en gris, et en vert). © Virgile Adam / IBS
Cinéma ultra-rapide d'une protéine en action. La protéine fluorescente (verte) est excitée par un laser de lumière visible (rayon violet) et impactée par une impulsion de rayons X (rayon blanc) produite par un laser X à électrons libres. Une picoseconde après excitation, le chromophore (bleu) au cœur de la protéine est observé à mi-chemin entre les deux formes stables (en gris, et en vert). © Virgile Adam / IBS
 Cinéma ultra-rapide d'une protéine en action. La protéine fluorescente (verte) est excitée par un laser de lumière visible (rayon violet) et impactée par une impulsion de rayons X (rayon blanc) produite par un laser X à électrons libres. Une picoseconde après excitation, le chromophore (bleu) au cœur de la protéine est observé à mi-chemin entre les deux formes stables (en gris, et en vert). © Virgile Adam / IBS
Cinéma ultra-rapide d'une protéine en action. La protéine fluorescente (verte) est excitée par un laser de lumière visible (rayon violet) et impactée par une impulsion de rayons X (rayon blanc) produite par un laser X à électrons libres. Une picoseconde après excitation, le chromophore (bleu) au cœur de la protéine est observé à mi-chemin entre les deux formes stables (en gris, et en vert). © Virgile Adam / IBSCes techniques d'analyse de structure atomique présentent aussi un intérêt pour les chercheurs intéressés aux nanoparticules non-biologiques. Par exemple la diffraction d'un rayonnement cohérent renseignent aussi sur le déplacement des atomes de leur position régulière ce qui permet d'accéder aux déformations internes aux nanoparticules et leur dynamique structurale par des expériences du type pompe-sonde.
Ce qui distingue l'European XFEL des autres XFELs (LCLS aux États-Unis, SACLA en Japon, PohangFEL en Corée du Sud et SwissFEL en Suisse) est la technologie supraconductrice de son accélérateur, ce qui lui permet d'émettre 200 fois plus d'impulsions X par seconde que les autres – une différence importante pour des expériences à faible efficacité (comme la cristallographie des nano-objets individuels) et qui permet la réalisation de plusieurs expériences en parallèle.
Des chercheurs français, déjà utilisateurs de toutes les sources XFEL opérationnelles au monde, participent aussi aux premières expériences au European XFEL qui sont réalisées sur l'instrument dédié à la cristallographie des nano-objets individuels. Cette communauté d'utilisateurs français des XFELs est soutenue par le réseau d'échange XFEL-Science, organisé comme un groupement de recherche international du CNRS, qui organise des écoles, réunions et workshops autour des thèmes liés à l'utilisation des XFELs. Des nouvelles sur des dernières découvertes et les avancements techniques sont diffusées à ces réunions par les scientifiques des lignes de lumières aux XFELs qui participent au réseau XFEL-Science.
Jan Luning (Laboratoire de Chimie Physique Matière et Rayonnement, Paris) et Martin Weik (Institut de Biologie Structurale, Grenoble)
Références:
Experimental strategies for imaging bioparticles with femtosecond hard X-ray pulses, B.J. Daurer et al., IUCrJ 4: 251-262 (2017)
Potential for biomolecular imaging with femtosecond X-ray pulses, R. Neutze, R. Wouts R., D. van der Spoel, E. Weckert & J. Hajdu, . Nature 406, 752–757 (2000).
Liens internet :
Jan Luning (Laboratoire de Chimie Physique Matière et Rayonnement, Paris) et Martin Weik (Institut de Biologie Structurale, Grenoble)
Références:
Experimental strategies for imaging bioparticles with femtosecond hard X-ray pulses, B.J. Daurer et al., IUCrJ 4: 251-262 (2017)
Potential for biomolecular imaging with femtosecond X-ray pulses, R. Neutze, R. Wouts R., D. van der Spoel, E. Weckert & J. Hajdu, . Nature 406, 752–757 (2000).
Liens internet :
- European XFEL
- L’inauguration de l'European XFEL
- Communiqué de presse du CEA et du CNRS sur l’inauguration d’European XFEL
- Communiqué de presse du CEA, du CNRS et de l’UGA sur le cinéma moléculaire ultra-rapide
- GDRi XFEL-Science : la prochaine réunion annuelle du GDRi XFEL-Science aura lieu en décembre à Paris. Pour s’en renseigner ou le joindre, contacter
Cette adresse e-mail est protégée contre les robots spammeurs. Vous devez activer le JavaScript pour la visualiser.





