Les premières protéines élucidées : hémoglobine et myoglobine
Le prix Nobel de chimie 1962 a été décerné conjointement à Max Perutz et John Kendrew "pour leurs études sur les structures des protéines globulaires". Ces protéines furent les premières dont la structure fut élucidée.
Quelles sont ces protéines globulaires et comment leur structure a-t-elle été élucidée ?En 1936, Max Perutz quitta sa ville natale, Vienne, pour s’établir à Cambridge en Angleterre. Il fit une rencontre décisive en la personne de John Bernal, à l’époque directeur du département de cristallographie au laboratoire Cavendish à Cambridge. J. Bernal avait été le premier à observer que des cristaux de protéines produisent des motifs caractéristiques par diffraction des rayons X. Ces motifs portent des informations précises sur la position des atomes et donc sur la structure à haute résolution de la protéine étudiée. Bernal convainquit Perutz que "le secret de la vie réside dans la structure des protéines, et la cristallographie aux rayons X est la seule manière de la résoudre" [1].
A l’époque, la structure des protéines était un problème majeur non résolu qui se situait à la limite de la chimie et de la biologie. C’est ainsi que Max Perutz devint cristallographe et commença en 1937 à travailler sur la structure de l'hémoglobine. La couleur, l’abondance et la facilité d’isolement de l’hémoglobine en avaient fait un objet de recherche depuis longtemps. De plus, cette protéine cristallisait très facilement dans les trois dimensions. Ce n’est qu’en 1959, vingt deux ans plus tard, que Perutz publia la structure de l’hémoglobine, structure plus complexe qu’initialement envisagé. Une dizaine d'années après l’arrivée de Max Perutz à Cambridge, en 1945, John Kendrew rejoint le groupe de recherche Perutz avec comme objectif de déterminer la structure de la myoglobine, une autre protéine globulaire.
L’hémoglobine se trouve dans les globules rouges, cette proté ine essentielle transporte l’oxygène (O2) des poumons vers les tissus et facilite le retour du dioxyde de carbone (CO2) des tissus vers les poumons. La myoglobine intervient au niveau des tissus, et lie l’oxygène libéré par l’hémoglobine pour le transporter au cœur des cellules, vers les mitochondries où l’oxygène va produire de l’énergie par combustion du glucose en dioxyde de carbone et eau.
L’hémoglobine est formée de quatre chaînes polypeptidiques, deux chaînes alpha (composée de 141 acides aminés) et deux chaînes beta (146 acides aminés). Les chaînes alpha et beta ont des séquences en acides aminés différentes mais ont une structure similaire dans les trois dimensions de l’espace. La myoglobine est similaire dans la constitution et dans la structure à une sous-unité bêta de l’hémoglobine ; elle est beaucoup plus simple car elle ne possède qu’une chaîne polypeptidique (comparé aux quatre chaînes de l’hémoglobine).
La myoglobine et chacune des quatre sous-unités de l’hémoglobine lient un groupement hème de façon non covalente. L'hème dérive d'une porphyrine formée de 4 noyaux pyrrole reliés par des ponts méthène, un atome de fer est placé au centre de l’hème comme un joyau, c’est sur ce fer que se fixera la molécule d’O2 (Voir ci-dessous). L’hème donne la couleur rouge au sang. Une solution de myoglobine ou d’hémoglobine ne contenant pas d’oxygène est rouge foncé comme le sang veineux ; lorsque la solution est saturée en oxygène, elle devient rouge vermillon comme la couleur du sang des artères.
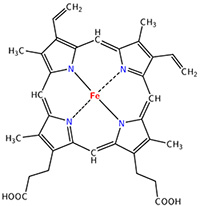
Structure d’un hème avec en son centre comme un joyau,
l’atome de Fer qui fixe l’oxygène O2.
La structure de la myoglobine (de cachalot) fut révélée en 1958 (voir ci-dessous), ce fut la première protéine dont on élucida la structure, puis, en 1959, la structure d’une deuxième protéine, l’hémoglobine fut élucidée. De nos jours, les structure moléculaire de plusieurs milliers de protéines sont déterminées chaque année en utilisant la technique de diffraction des rayons X.
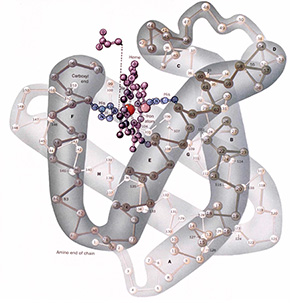
Structure de la Myoglobine
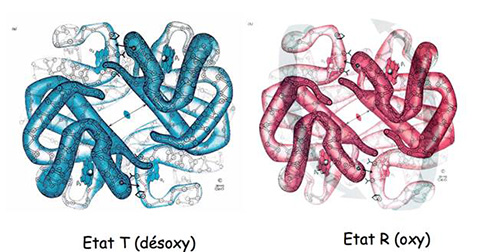
Structure de l’hémoglobine sans O2 lié (désoxy) ou avec l’O2 lié (oxy), ces deux structures sont légèrement différentes.
Régulation allostérique et coopérativité
L'hémoglobine a servi de modèle pour comprendre la relation entre la structure et la fonction d'une protéine, plus précisément dans ce cas, la régulation, principalement d’activités enzymatiques.
L’hémoglobine fixe l’O2 de manière coopérative, c’est-à-dire que la liaison d’une première molécule d’O2 augmente l’affinité de l’hémoglobine pour la liaison de molécules d’O2 supplémentaires (coopérativité positive de fixation d’O2). La compréhension de ce phénomène s’est faite grâce à la connaissance de la structure de l’hémoglobine avec (oxy) ou sans (deoxy) oxygene (figure 4) , un changement de conformation subtil entre les deux états permet de comprendre cette coopérativité et de proposer la théorie de l’allostérie.
L’allosterie est un phénomène de changement de conformation intramoléculaire, déclenché par la fixation d'une molécule effectrice en un site, et qui modifie les conditions de fixation d'une (ou plusieurs) autre(s) molécule(s), en un (ou plusieurs) autre(s) site(s) distant(s) de la protéine. Ce phénomène explique pourquoi au niveau des poumons, spontanément, l'hémoglobine se charge en O2 et que la fixation d’une première molécule d’O2 accélère le chargement des autres molécules d’O2 (il y a quatre sites de fixation de l’O2 par hémoglobine). Au niveau des tissus, l'hémoglobine libère spontanément l'O2, et l'allostérie accélère le déchargement (car un O2 libéré engendre une moins grande affinité sur les autres sites). Des modifications conformationnelles subtiles sont à la base de ces régulations fines. En outre Perutz a étudié les changements structurals dans un certain nombre de maladies de l'hémoglobine, comme l’anémie falciforme, et la façon dont ceux-ci pourraient affecter la liaison de l'oxygène.
I wish I’d make you angry earlier (Essays on Science and Scientists) Max Perutz Oxford Press
http://www.nobelprize.org/nobel_prizes/themes/medicine/perutz/