C'est bien connu, les bactéries font preuve d'une grande capacité d'adaptation. Adapter son comportement en fonction de son environnement est crucial pour tous les organismes : les bactéries traitent l'information chimique ou physique pour y répondre. Dans un article publié récemment dans la revue Science, un consortium international, dont des chercheurs à l'Institut de Biologie Structurale à Grenoble, présente un système d'adaptation via un simple ligand nitrate.
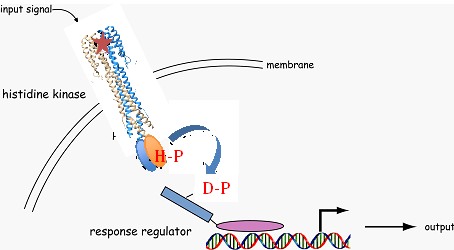 Un des principaux dispositifs d'adaptation est un système dit « à deux composants » : un récepteur membranaire, généralement dimérique, reçoit un stimulus et change de conformation (figure à gauche, adaptée de https://doi.org/10.1371/journal.pbio.0030359.g001). Dans le cas des histidines kinases, ce changement est propagé à travers la membrane jusqu'au domaine kinase qui phosphoryle un acide aminé histidine. Le phosphate ainsi fixé est ensuite transféré sur un acide aminé glutamate du second partenaire, provoquant un changement qui lui permet de se fixer à l'ADN et d'activer l'expression d'un gène de réponse à ce stimulus.
Un des principaux dispositifs d'adaptation est un système dit « à deux composants » : un récepteur membranaire, généralement dimérique, reçoit un stimulus et change de conformation (figure à gauche, adaptée de https://doi.org/10.1371/journal.pbio.0030359.g001). Dans le cas des histidines kinases, ce changement est propagé à travers la membrane jusqu'au domaine kinase qui phosphoryle un acide aminé histidine. Le phosphate ainsi fixé est ensuite transféré sur un acide aminé glutamate du second partenaire, provoquant un changement qui lui permet de se fixer à l'ADN et d'activer l'expression d'un gène de réponse à ce stimulus.En présence de nitrates, les bactéries peuvent passer d’un mode aérobie à un mode de respiration anaérobie. Le récepteur NarQ sensible au nitrate fonctionne avec le facteur de transcription NarP qui active l’expression de gènes permettant l’adaptation des bactéries au taux de nitrate. Mais jusqu'à présent, le mécanisme de transmission du signal n’était pas connu au niveau structural.
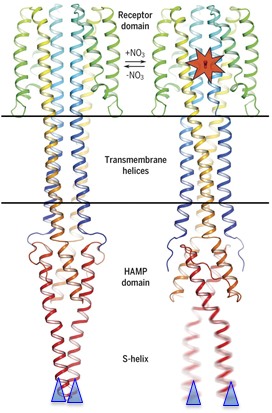 Dans un article publié dans Science (Gushchin et al., 2017), le groupe de l’IBS décrit les structures cristallines d’une grande partie de NarQ avec et sans ligand nitrate (figure à droite, Fig. 4 de l'article de Science). La structure de NarQ est un dimère et comporte 3 domaines. Le domaine récepteur situé dans le périplasme fixe l’ion nitrate (étoile orange), et son changement de conformation est transmis à la partie transmembranaire dont les hélices changent d’orientation relative et bougent de 2.5 Å. À leur tour, les hélices du domaine cytoplasmique HAMP se déforment dans un mouvement de levier amplifié qui fait bouger de 7 Å l’extrémité (triangles bleus) du domaine HAMP. C’est cette extrémité qui fait le lien avec le reste de la protéine, absent de cette structure et qui inclut le domaine kinase. Il est probable que celui-ci subit une importante modification en conséquence. La comparaison entre structures sans et avec ligand permet donc de montrer que la fixation d’un modeste ion nitrate engendre, 100 Å plus, bas un mouvement de grande amplitude capable de modifier l’orientation relative de deux domaines.
Dans un article publié dans Science (Gushchin et al., 2017), le groupe de l’IBS décrit les structures cristallines d’une grande partie de NarQ avec et sans ligand nitrate (figure à droite, Fig. 4 de l'article de Science). La structure de NarQ est un dimère et comporte 3 domaines. Le domaine récepteur situé dans le périplasme fixe l’ion nitrate (étoile orange), et son changement de conformation est transmis à la partie transmembranaire dont les hélices changent d’orientation relative et bougent de 2.5 Å. À leur tour, les hélices du domaine cytoplasmique HAMP se déforment dans un mouvement de levier amplifié qui fait bouger de 7 Å l’extrémité (triangles bleus) du domaine HAMP. C’est cette extrémité qui fait le lien avec le reste de la protéine, absent de cette structure et qui inclut le domaine kinase. Il est probable que celui-ci subit une importante modification en conséquence. La comparaison entre structures sans et avec ligand permet donc de montrer que la fixation d’un modeste ion nitrate engendre, 100 Å plus, bas un mouvement de grande amplitude capable de modifier l’orientation relative de deux domaines.Du fait de la conservation des systèmes à deux composants, ce mécanisme pourra servir à modéliser d’autres réponses cellulaires. Cette structure apporte des réponses concernant le mécanisme proximal de l’activation et laisse ouvertes plusieurs questions: comment se fait le relais vers le domaine kinase intracellulaire, et la transduction vers le deuxième partenaire.
Gushchin I, Melnikov I, Polovinkin V, Ishchenko A, Yuzhakova A, Buslaev P, Bourenkov G, Grudinin S, Round E, Balandin T, Borshchevskiy V, Willbold D, Leonard G, Büldt G, Popov A, Gordeliy V. Mechanism of transmembrane signaling by sensor histidine kinases. Science 356, p1043 (2017).
Texte: Valérie Biou (Institut de Biologie Physico-Chimique, Paris - octobre 2017)




