Depuis la première pile électrochimique mise au point par Volta en 1800, les piles électriques (salines, alcalines) puis les batteries rechargeables (NiCd, Li-Ion,..) sont devenues des sources d’électricité utilisées quotidiennement pour nos appareils mobiles. La recherche actuelle porte sur le design de nouveaux dispositifs pour le stockage de l’énergie variable produite par les panneaux solaires ou les éoliennes (écrêtage), la motorisation de véhicules électriques, ou l’alimentation avec une autonomie accrue de dispositifs nomades (ordinateurs portables, téléphones mobiles…) de plus en plus gourmands électriquement.
Piles et accumulateurs
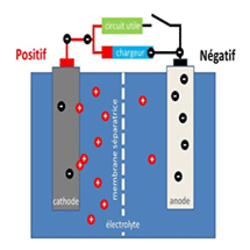
Dans une batterie ou une pile électrochimique, l’électricité est produite par l’oxydation sur une électrode d’un REDucteur (ex. H+/H ou Li+/Li) simultanément à la réduction sur l’autre électrode d’un Oxydant. Une membrane séparatrice bloque les électrons de la réaction REDOX, qui doivent emprunter le circuit électrique qu’on cherche à alimenter, tandis qu’un électrolyte transporte les autres porteurs de charge. La nature du couple REDOX détermine la tension nominale (3.2 V pour les accumulateurs LFP, par ex.), alors que la charge électrique (quantité d'électricité emmagasinée, en A.h) dépend de la quantité d’ions actifs dans les 2 cathodes et dans l’électrolyte, et de la conduction ionique dans la membrane séparatrice.
Diffraction neutronique et batteries
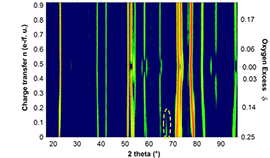 La diffraction neutronique est plus sensible aux atomes légers et permet une meilleure estimation de leurs déplacements atomiques que la diffraction X. Elle permet d’étudier les matériaux d’électrodes (désintercalation de Li+ ou diffusion de O2-) ou les hydrures intermétalliques utilisés comme réservoir des piles à combustible (adsorption de H).
La diffraction neutronique est plus sensible aux atomes légers et permet une meilleure estimation de leurs déplacements atomiques que la diffraction X. Elle permet d’étudier les matériaux d’électrodes (désintercalation de Li+ ou diffusion de O2-) ou les hydrures intermétalliques utilisés comme réservoir des piles à combustible (adsorption de H).
Pour en savoir plus : le fonctionnement d’une pile à l’échelle atomique
Lors de la décharge d’un accumulateur Li-ion (ex. batterie LFP),
- l’ion Li+ peut se désintercaler de la cathode, formée de LiFePO4 : LiFePO4 -> nLi+ + ne- + Li1-n FePO4
- le Li+ migre via un électrolyte jusqu’à l’anode en graphite où il se recombine : nLi+ + ne- + C -> LinC
La réaction inverse a lieu lors de la charge. La conductivité électrique de la cathode est améliorée en réduisant la taille des cristaux ou en les dopant avec Al, Nb, Zr. La stabilité thermique et chimique des batteries LFP vient de la force des liaisons Fe-O/P-O qui maintiennent l’intégrité de la structure lors de la désintercalation.
Dans une pile à combustible à hydrogène à membrane solide (type SOFC),
- l'hydrogène H2 arrive sur l'anode où il se dissocie : 2H2 = 4H+ + 4e-
- les protons H+ restent sur l'électrode
- les électrons (e-) empruntent le circuit extérieur, puis rejoignent la cathode chargée en oxygène O2.
- des anions oxydes O2- se forment à la cathode par recombinaison : O2 + 4e– -> 2 O2-.
- les ions O2- traversent la membrane et se recombinent avec H+ sur l’anode : 4H+ + 2O2- -> 2 H2O
Les piles à combustible à hydrogène sont propres puisqu'elles ne produisent que de l'eau. Leur coût est cependant élevé, notamment à cause des membranes échangeuses d'ions ou du platine utilisé comme catalyseur. La recherche porte, entre autres, sur le stockage sûr de H2 (hydrures intermétalliques, MOFs...) ou l’amélioration de la conductivité ionique de la membrane à oxyde solide (SOFC) afin de pouvoir travailler à température ambiante.