Dans un article paru en 2018 sur le site de l'Association Française de Cristallographie, Samuel Tranier et Jean-Denis Pedelacq rapportent comment la caractérisation par rayons-X d'une enzyme mangeuse de PET aide à comprendre le mécanisme de la dépolymérisation enzymatique du polytéréphtalate d’éthylène (PET). Ils écrivent à la fin de leur article que tout reste à optimiser avant de pouvoir envisager une application industrielle. Depuis les travaux n'ont pas cessé: dans un article paru dans Nature (Avril 2020), des chercheurs toulousains et auvergnats décrivent une étape importante pour une application industrielle et comment la biologie structurale a été décisive pour guider les modifications à apporter pour améliorer les performances de l’enzyme.
Les plastiques sont rapidement devenus les matériaux synthétiques les plus produits et utilisés dans l’histoire de l’humanité. Bien que leur production à grande échelle ne date que des années 1950, un monde sans plastiques semble aujourd’hui inimaginable. Ces matériaux ont voulu apporter à notre société confort, hygiène, sureté, bien être, en se présentant sous une déclinaison infinie de produits et d’applications. Si les plastiques ont sans aucun doute changé, modelé nos vies présentes, ils modèleront encore probablement nos vies futures. Cependant, pour tirer le meilleur de ces matériaux, d’énormes challenges existent à l’heure actuelle en ce qui concerne la gestion de leur fin de vie. Pour en prendre pleine conscience, la simple observation de notre environnement (aussi bien terrestre que marin) permet de rendre compte à quel point le système de recyclage est défectueux. Les chiffres sont d’autant plus alarmants. En 2018, la production globale de plastiques atteignait les 360 millions de tonnes dont presque 200 millions de tonnes n’étaient pas traitées, s’accumulant alors dans les décharges et la nature 1.
Le polytéréphtalate d’éthylène (PET) est l’un des polyesters les plus produits au monde avec environ 70 millions de tonnes annuelles, production qui devrait d'ailleurs encore croître de presque 4% annuellement jusqu'en 2025. Il sert chaque année à la fabrication de 500 milliards de bouteilles, fibres textiles et emballages 2. Le processus principal de recyclage du PET est thermomécanique, mais il ne permet de recycler qu’une petite fraction des déchets, et engendre des problèmes de perte de ses propriétés. En conséquence, la synthèse de novo est préférée. Lorsqu’il est recyclé, seulement 25 % environ du PET est réintroduit dans des bouteilles neuves. Ce nouveau plastique étant de qualité inférieure, il est préférentiellement utilisé dans le textile et finira de toute façon par s’accumuler dans les déchèteries ou dans l’environnement.
Bien que le PET soit difficilement dégradable par voie microbienne, quelques PET hydrolases ont été identifiées et décrites comme ayant la capacité de décomposer ce plastique en ses éléments de base que sont l’éthylène glycol et l’acide téréphtalique 3. En 2016, des chercheurs japonais annonçaient la découverte d’une nouvelle PET hydrolase (nommée Is-PETase) produite par la bactérie Ideonella sakaiensis 201-F6 4. Cette découverte enthousiasma la communauté scientifique mondiale. Malheureusement, cette enzyme comme les autres est encore loin d’une utilisation pour un biorecyclage enzymatique économiquement viable 5,6.
 Dans la revue Nature du 9 avril 2020 (crédits Image : Randy Olson/National Geographic) 7, des chercheurs du Toulouse Biotechnology Institute (TBI, Université de Toulouse, CNRS, INRAE, INSA), en partenariat avec la société auvergnate de bioplasturgie Carbios, ont démontré que ce challenge pouvait être relevé. Ces chercheurs ont en effet développé une enzyme capable de dépolymériser le PET et ceci en quelques heures seulement 7. Pour réaliser cette prouesse, ils ont utilisé une PETase oubliée, appelée LCC 8 (Leaf Compost Cutinase) découverte quelques années plus tôt mais dont l’efficacité était encore trop faible pour une utilisation industrielle. Pour créer une super PETase, deux paramètres essentiels nécessitaient d’être améliorés par mutagénèse : l’activité estérase (c.-à-d. de dépolymérisation du PET) d’une part, et la thermostabilité d’autre part. En effet, la réaction de dépolymérisation du PET doit être conduite aussi proche que possible de 70°C, ce qui correspond à la température de transition vitreuse du PET, autrement dit la température à laquelle le plastique passe d’un état solide à visqueux et offre ainsi à l’enzyme un accès facilité aux chaines rendues mobiles du polymère.
Dans la revue Nature du 9 avril 2020 (crédits Image : Randy Olson/National Geographic) 7, des chercheurs du Toulouse Biotechnology Institute (TBI, Université de Toulouse, CNRS, INRAE, INSA), en partenariat avec la société auvergnate de bioplasturgie Carbios, ont démontré que ce challenge pouvait être relevé. Ces chercheurs ont en effet développé une enzyme capable de dépolymériser le PET et ceci en quelques heures seulement 7. Pour réaliser cette prouesse, ils ont utilisé une PETase oubliée, appelée LCC 8 (Leaf Compost Cutinase) découverte quelques années plus tôt mais dont l’efficacité était encore trop faible pour une utilisation industrielle. Pour créer une super PETase, deux paramètres essentiels nécessitaient d’être améliorés par mutagénèse : l’activité estérase (c.-à-d. de dépolymérisation du PET) d’une part, et la thermostabilité d’autre part. En effet, la réaction de dépolymérisation du PET doit être conduite aussi proche que possible de 70°C, ce qui correspond à la température de transition vitreuse du PET, autrement dit la température à laquelle le plastique passe d’un état solide à visqueux et offre ainsi à l’enzyme un accès facilité aux chaines rendues mobiles du polymère.
Les techniques de modélisation moléculaire et de biologie structurale ont été décisives pour comprendre les déterminants moléculaires clés et guider les modifications à apporter pour améliorer les performances de l’enzyme. En effet, l’obtention de la structure cristalline à très haute résolution de la nouvelle enzyme, combinée à des études de modélisation et dynamique moléculaires ont permis de concevoir une enzyme avec des caractéristiques de thermostabilité et d’activité considérablement améliorées (fig. 1). Cette nouvelle enzyme permet aujourd’hui d’atteindre un taux de dépolymérisation du PET en acide téréphtalique et mono éthylène glycol de 90% en seulement 10 heures, soit une productivité augmentée d’un facteur 100 en comparaison des résultats publiés jusque-là dans la littérature. A partir des monomères purifiés, Carbios, en collaboration avec le Critt Bio-Industries de l’Insa de Toulouse, a réussi à produire de nouvelles bouteilles aux propriétés identiques à celles produites par polymérisation de monomères issus de la pétrochimie, démontrant ainsi la circularité du procédé.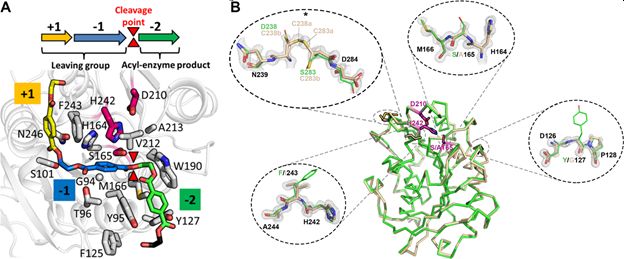
Ceci constitue une première mondiale, qui ouvre la voie au déploiement par Carbios d’une technologie d'économie circulaire applicable à tous les déchets PET, et qui offre une solution de rupture face aux problèmes environnementaux et industriels que pose actuellement l’utilisation massive des matières plastiques. Cette nouvelle technologie ouvre également la voie au recyclage des fibres en PET, prochain défi pour garantir aux générations futures un monde plus respectueux de l’environnement.
Texte : Julian Nommé (Toulouse Biotechnology Institute, Bio & Chemical Engineering (ex.LISBP))
28 avril 2020
Références
- Plastics - the Facts 2019. (2019).
- PET Polymer - Chemical Economics Handbook (CEH) | IHS Markit. Available at: https://ihsmarkit.com/products/pet-polymer-chemical-economics-handbook.html.
- Wei, R. & Zimmermann, W. Microbial enzymes for the recycling of recalcitrant petroleum-based plastics : how far are we ? Microbial Technology.(2017).
- Yoshida, S. et al. A bacterium that degrades and assimilates poly(ethylene terephthalate. Science 351, 1196–1199 (2016).
- Liu, B. et al. Protein Crystallography and Site‐Direct Mutagenesis Analysis of the Poly(ethylene terephthalate) Hydrolase PETase from Ideonella sakaiensis. ChemBioChem 19, 1471–1475 (2018).
- Austin, H. P. et al. Characterization and engineering of a plastic-degrading aromatic polyesterase. Proc. Natl. Acad. Sci. U. S. A. 115, E4350–E4357 (2018).
- Tournier, V. et al. An engineered PET depolymerase to break down and recycle plastic bottles. Nature 580, 216–219 (2020).
- Sulaiman, S. et al. Isolation of a novel cutinase homolog with polyethylene terephthalate-degrading activity from leaf-branch compost by using a metagenomic approach. Appl. Environ. Microbiol. 78, 1556–1562 (2012).




